传统给药的三大暴击
口服——“首过效应”直接削你90%药效
静注——手一抖,鼠鼠当场去世
涂抹——角质层:想进来?先过我“铜墙铁壁”
在小鼠皮肤给药相关临床前研究中,科研人员常面临小鼠口服给药首过效应导致药物利用率低、小鼠静脉注射操作难点(精准定位血管难、易引发感染)、小鼠皮肤外用制剂渗透不足(仅停留角质层)等核心问题。而微针技术凭借 “微米级精准穿透 + 物理促渗” 特性,成为解决小鼠透皮递药效率低、皮肤局部给药靶向性差等难题的关键工具。本文将从技术原理、实操规范、多动物模型应用及风险控制展开解析,为动物科研微针给药实验提供系统性指导。
一、技术核心
微针为何成为小鼠皮肤给药的优选方案?
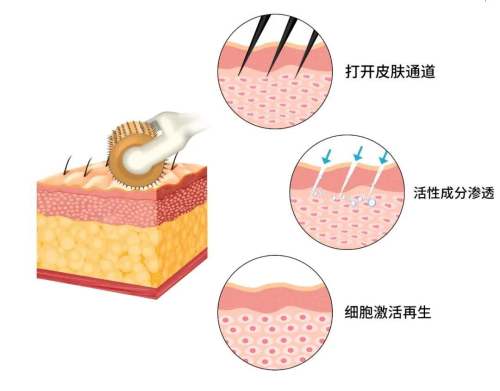
微针技术的优势源于对小鼠皮肤结构(厚度约 0.8-1.2mm)的精准适配,其50-500μm 微米级针头可穿透角质层屏障却不触及真皮层神经血管,完美解决传统给药的痛点。通过与常见给药方式的对比,更能凸显其在动物模型药物递送中的价值:

此外,微针可通过预负载药物实现定量递送,避免因给药剂量波动影响小鼠实验数据重复性;针对皮肤病变部位精准递药,减少药物对小鼠全身组织的副作用,尤其适配小鼠皮肤肿瘤局部给药、小鼠雄激素脱发毛囊靶向递药等细分研究方向。
二、实操规范
微针介导小鼠皮肤给药实验操作全流程
小鼠微针给药实验的成功率取决于细节把控,需严格遵循 “术前准备 - 核心操作 - 术后观察” 三阶段规范,每个环节均需匹配科研人员的实操需求:
(1)实验材料选择(适配科研需求)
-
微针阵列:根据研究方向选类型 ——实心微针适用于药物涂抹 / 预负载(如小鼠皮肤肿瘤化疗药递送),空心微针适用于液体药物直接注射(如小鼠疫苗递送);优先选无菌一次性微针(避免小鼠交叉感染),针头长度≤500μm(防止穿透小鼠真皮层出血)。

-
实验动物:选用 6-8 周龄、体重 20-25g 的 SPF 级小鼠(常用品系如 C57BL/6),提前适应性饲养 1 周(减少小鼠环境应激对实验的干扰);
-
同一批次实验保证小鼠品系、性别、健康状态一致(控制变量,确保数据可靠)。
-
药物与辅助材料:给药制剂需提前调整浓度(适配微针载药量),液体制剂单次体积≤50μL(避免溢出影响吸收);
-
准备无菌操作台、医用脱毛膏(小鼠专用,减少皮肤刺激)、生理盐水、碘伏、异氟醚麻醉剂(小鼠吸入麻醉剂量控制:1%-3% 浓度,维持呼吸平稳)。
(2)小鼠皮肤预处理(保障药物渗透)
-
给药前 24h,用脱毛膏去除小鼠背部 2×3cm 范围毛发(毛发会影响微针与小鼠皮肤贴附紧密性,导致药物渗漏);生理盐水轻柔清洁脱毛区域,重点检查皮肤是否有红肿、破损、炎症(若有异常,需更换小鼠或调整部位,避免影响小鼠皮肤药物吸收效率);给药前 10min,通过异氟醚吸入麻醉(麻醉深度以小鼠无自主活动、呼吸平稳为宜),将小鼠固定于无菌操作台(背部朝上,暴露给药区域)。
2. 核心操作 微针给药三步精准执行(附参数标准) (1)药物负载与微针准备
-
实心微针:将药物制剂均匀涂抹于微针表面(厚度约 5-10μm),或提前将药物嵌入微针基质(如可降解 PLGA 微针,适用于小鼠长效释药实验);
-
空心微针:用 10μL 微量注射器将药物缓慢注入针管,注射过程中轻推针芯排尽气泡(气泡会导致小鼠给药剂量偏差,影响实验重复性)。
(2)微针贴附与压力控制(关键操作点)
-
无菌棉签蘸取碘伏,轻擦小鼠背部脱毛区域消毒(待碘伏完全挥发后操作,残留碘伏可能与药物反应,或改变小鼠皮肤渗透性);手持微针阵列,使针头垂直对准给药部位,均匀施加 5-10N 压力(压力过小易导致针头未穿透角质层,过大易损伤小鼠皮肤),保持压力 10-30 秒(确保针头完全穿透角质层,可通过显微镜观察微针入皮状态)。
-
-

(3)药物释放与微针移除
-
可降解微针:保持贴附状态 5-10 分钟(根据微针降解速率调整,如小鼠皮肤局部治疗实验中,PLGA 微针需停留 8 分钟确保完全释药);
-
不可降解微针:贴附 30 秒后缓慢移除(避免拉扯小鼠皮肤),用无菌棉签轻压给药部位 1 分钟(促进残留药物向真皮层渗透,减少药物随创口渗出)。
3. 术后观察与数据记录 保障实验完整性 -
给药后将小鼠单独饲养,24 小时内每 6 小时观察一次小鼠皮肤给药部位反应(记录是否出现红肿、渗液、结痂,若红肿持续超 48 小时,需排查药物过敏或创口感染);
-
监测小鼠食欲、活动量、体重变化(评估微针给药对小鼠整体健康的影响,避免因动物状态异常导致实验数据偏差);
-
按实验设计检测指标(如通过高效液相色谱 HPLC 检测小鼠皮肤组织药物浓度,或免疫组化分析靶细胞响应,如毛囊再生、肿瘤细胞凋亡等)。
三、应用场景
微针技术在多动物模型中的科研价值
微针技术不仅适用于小鼠模型,在大鼠、兔、小型猪等临床前动物模型中同样具备明确应用场景,覆盖多个科研方向:
1. 小鼠模型(基础研究核心场景)
-
小鼠皮肤肿瘤研究:通过空心微针向黑色素瘤病灶递送阿霉素(化疗药),对比静脉注射组,可减少药物对小鼠肝脏、肾脏的毒副作用,提高小鼠肿瘤局部药物浓度(实验数据显示,微针组肿瘤抑制率提升 30%-40%);
-
小鼠雄激素脱发研究:可降解微针负载 17 型胶原蛋白 + 米诺地尔,靶向递送至 DHT 诱导的脱发区域,促进毛囊干细胞激活(免疫荧光检测显示,给药 2 周后小鼠毛囊密度增加 2 倍);
-
小鼠透皮递药机制验证:荧光标记药物(如 FITC - 胰岛素)通过微针递送,激光共聚焦显微镜观察药物在小鼠皮肤各层的分布,分析微针参数(长度、密度)对渗透速率的影响。
2. 大鼠 / 兔 / 小型猪模型(临床前转化场景)
-
大鼠模型:适用于大鼠皮肤创伤修复研究(微针递送表皮生长因子 EGF,加速创面愈合,实验显示创口愈合时间缩短 30%)、大鼠糖尿病皮肤并发症治疗(负载胰岛素的微针实现长效血糖控制,降糖效果维持 12 小时);
-
兔模型:因皮肤特性接近人类,用于兔皮肤刺激性测试(微针贴附后观察 24/48/72 小时皮肤反应,判断药物 / 设备安全性)、兔银屑病模型微针递药验证(递送糖皮质激素,评估抗炎效果及皮肤渗透深度);
-
小型猪模型:皮肤结构与人类高度一致,用于小型猪慢性创面微针递药研究(递送干细胞外泌体,评估创面愈合速度及组织再生质量)、微针设备临床前性能测试(验证微针贴附稳定性与药物递送一致性)。
此类多动物模型微针给药实验,需依赖专业的动物饲养环境、标准化模型构建及配套检测技术支持。深圳灵赋拓普生物作为动物科研一站式服务提供商,可提供从 “小鼠 / 大鼠 / 兔 / 小型猪模型制备” 到 “微针给药实验执行” 再到 “病理检测、药物浓度分析” 的全流程支持,解决科研人员在模型构建、操作规范、数据检测中的痛点。
四、实验避坑
微针介导小鼠皮肤给药关键注意事项
-
微针参数匹配:根据研究目的调整 ——小鼠短期药物递送选不可降解微针(如金属微针),小鼠长效释药实验选可降解微针(如 PLGA、透明质酸微针);针对小鼠腹部等薄皮肤区域,针头长度需≤300μm(避免穿透真皮层)。
-
-
皮肤状态控制:脱毛后需等待 24 小时再给药(让小鼠皮肤恢复,减少脱毛膏残留刺激);若皮肤有微小创口,需立即更换部位(防止药物通过创口直接入血,导致小鼠给药剂量失控)。
-
-
剂量精准控制:液体制剂用 10μL/20μL 微量移液器定量(避免凭经验估算);预实验阶段需通过 HPLC 检测小鼠皮肤内药物浓度,确定最佳给药剂量(如小分子药物单次给药量通常为 10-50μg,蛋白质药物为 5-20μg)。
-
-
术后感染防控:给药后可给小鼠佩戴伊丽莎白圈(防止抓挠给药部位导致创口扩大);若出现皮肤感染,需及时使用青霉素(5 万 U/kg,腹腔注射),同时评估抗生素对实验药物的干扰(避免影响小鼠实验结果准确性)。
微针介导小鼠皮肤给药技术的规范应用,是推动皮肤局部治疗研究、透皮递药机制验证、临床前疫苗递送实验的关键。若您在实验设计、动物模型构建或检测分析中存在需求,深圳灵赋拓普生物可提供定制化 CRO 解决方案,助力科研项目高效落地。 全流程技术服务 -
模型构建:可定制小鼠皮肤肿瘤模型、小鼠雄激素脱发模型、兔银屑病模型、小型猪慢性创面模型等,覆盖微针给药研究核心场景;
-
实验执行:提供标准化微针给药操作(含小鼠预处理、麻醉、给药、术后观察),配备专业技术团队保障实验操作规范性,降低人为误差;
-
检测分析:配套病理技术服务(皮肤组织切片、免疫组化)、生化技术服务(药物浓度检测、肝肾功能评估)、分子蛋白技术服务(靶基因 / 蛋白表达分析),为实验数据提供专业、精准的检测支撑。
合作咨询
CONTACT INFORMATION 联系电话 0755-86325431 联系邮箱 sales@topbiotech.com.cn 联系地址 深圳市光明区凤凰街道同业路恒泰裕大厦3B栋1502室
-
-
